维生素C又称抗坏血酸,是人体内重要的微量营养素之一,参与人体内多种生化反应。维生素C的生理作用包括促进胶原蛋白合成,参与氨基酸代谢,调节氧化还原代谢反应等。
目前维生素C已广泛应用于感染性疾病,过敏性反应,心血管系统疾病,糖尿病等临床辅助治疗[1]。自20世纪70年代以来,高剂量的维生素C抗肿瘤治疗一直有争议:部分研究表明维生素C具有抗肿瘤活性;部分研究显示维生素C并没有什么效果。早期的研究声称高剂量的抗坏血酸有显著的抗癌效果。CameronE等[2]曾在文章中指出,每天给予患者注射10g维生素C能有效治疗肿瘤并提高患者生活质量。然而在梅奥医学中心开展的两项双盲-随机临床试验中并没有显示出任何效果。随后,维生素C在肿瘤方面的治疗被认为是无效的。多年后临床数据证实,当口服给予维生素C时,其在血浆中的浓度难以升高[3]:口服200mg的维生素C,其在血浆中的浓度稳定在约80μM;当口服大于200mg时,维生素C的吸收下降并且从尿液中的排除量升高。即便在每天给予6次口服维生素C,每次3g的剂量下,血浆中维生素C最高值也不超过220μM[4]。相反,当通过静脉注射给予时,血浆中的维生素C可以达到毫克单位量。给予癌症患者注射10g维生素C可以使血浆中的浓度升高到1~5mM[5, 6]。因此,研究人员认为:以前实验结果的不同源于他们使用维生素C的途径有所不同。本文就近日康奈尔医学院学者发表的维生素C在KRAS、BRAF突变基因导致的结直肠癌的特异性抗肿瘤方面的研究予以综述[7]。
肿瘤细胞的能量代谢
能量代谢是指有机物在物质代谢过程中能量的产生、释放、转换及利用的过程。肿瘤细胞在生物能量代谢上与人体正常细胞有所不同。细胞代谢依赖ATP供能,正常细胞可以通过糖酵解和氧化磷酸化产生ATP。肿瘤细胞只能通过有氧糖酵解(Warburg 效应)产生大量乳酸和少量的ATP为细胞供能,并为新细胞的构筑提供多种生物大分子[8]。肿瘤细胞的糖酵解能力是正常细胞的20~30倍,糖酵解的增强与肿瘤的生长速度成正比,而与分化程度成反比[9]。研究表明,线粒体受到不可逆损伤、肿瘤缺氧微环境、原癌基因激活与抑癌基因失活等共同促成Warburg效应[10,11]。肿瘤细胞的代谢模式已成为新的肿瘤标志现象,也是肿瘤治疗的潜在靶点。
KRAS与BRAF基因
KRAS基因位于12号染色体上,是表皮生长因子受体(epithelial growth factor receptor,EGFR)功能信号的下游分子,在膜受体到腺苷环化酶信号转导中起重要作用[12,13]。在Ras基因家族中(包括K-ras、H-ras、N-ras),K-ras基因的突变率最高,并且与肿瘤的发生有密切关系。目前,KRAS基因(K-ras,21)检测是了解大肠癌患者癌基因状况最直接有效的方法。BRAF基因是Ras的下游基因,属于RAF基因家族的一员,是Ras-RafMEK-ERK信号转导通路重要的转导因子,可以启动多种因子参与调控细胞生长,分化和凋亡等多种生物学事件。BRAF突变基因对肿瘤发生的促进作用一方面在于持续刺激丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,使细胞不断有丝分裂;另一方面在于其抑制促凋亡因子(bcl-2 interacting mediator of cell death,BIM)致使细胞异常增生分化[14]。BRAF突变状态与多种肿瘤的发生、发展及临床结局有关, 可为结直肠癌的诊断、治疗提供依据[15]。在结直肠癌中,含有KRAS、BRAF突变基因的病例分别占到40%和10%。因此找到合适于KRAS、BRAF突变基因的靶向治疗是至关重要的。
维生素C抗肿瘤治疗的实验证据
葡萄糖转运体(glucose transporter,GLUT),是一类镶嵌在细胞膜上运转葡萄糖的载体蛋白。通过扫描术测量发现,GLUT1的水平在含有KRAS、BRAF突变基因的结直肠癌细胞中有所升高,并伴有葡萄糖摄入的升高[16]。GLUT1除了可以将葡萄糖运输到细胞中,还可以将脱氢抗坏血酸(dehydroascorbic acid,DHA,氧化形式的维生素C)转运到细胞内。DHA在进入细胞后与谷胱甘肽(glutathione,GSH)、还原性辅酶(NADPH)等还原剂反应后被还原成维生素C,同时消耗掉细胞内还原剂[17]。因此Yun J等[7]人提出假设:高DHA的摄入可以干扰内环境的氧化还原反应从而使细胞失活。
1 DHA在肿瘤细胞内的转运
在未加入还原剂的情况下,维生素C在细胞培养基中被氧化为DHA。Yun J等人[7]用含有同基因的结直肠癌细胞株进行试验:在两组细胞株内分别加入还原剂GSH或GLUT1抑制剂STF,结果表明两组实验细胞株内的维生素C摄入明显减少;将第三组细胞株中的GLUT1去除后加入维生素C,发现维生素C的摄入同样明显降低了。考虑到GLUT1在突变基因细胞中的增强表达,将对照组普通细胞株中的GLUT1增加到与突变组等量的情况下观察,维生素C的摄入并没有明显的增加。以上实验可以得出结论:①GLUT1能使维生素C转运到细胞内;②维生素C需要氧化成DHA才能被GLUT1转运;③只有在突变基因株中维生素C的摄入会增高。
2 DHA对突变基因细胞生长和生存的影响
为了检测细胞内的DHA升高是否会影响突变基因细胞的生存和生长,Yun J等[7]将放入葡萄糖媒介中培养后的实验组突变细胞株和含有同量GLUT1浓度的对照组普通细胞株同时给予维生素C治疗,突变细胞的生长和群落的形成均被抑制,然而对照组无明显反应。因此可以得出结论:只有经过癌基因诱导代谢重编程后,通过GLUT1的高表达才能导致DHA大量摄入,并对细胞的生长和生存产生影响。
以这个理论为依据对怀有KRAS、BRAF突变细胞移植瘤的小鼠进行试验,给予实验组小鼠腹腔内每日2次注射高剂量(4g/kg)维生素C,持续3~4周,对照组小鼠给予安慰剂注射。结果显示:治疗组小鼠的肿瘤生长明显减弱;对照组小鼠因肿瘤生长死亡。为进一步检测维生素C是否特征性的对KRAS突变细胞有效,Yun J等[7]组建两组结直肠癌转基因模型,分别含有APC突变基因和APC/KRAS突变基因。在给予高剂量维生素C治疗后,结果显示APC组小鼠无明显变化,而APC/KRAS小组165例小鼠中有76例小鼠的肠息肉有明显的减小,并且APC/KRAS组小鼠的GLUT1表达和维生素C摄入量均明显高于APC组。因此可以判定:维生素C对KRAS突变基因的灭杀具有特征性,对APC突变基因无明显影响。以上实验得出结论:KRAS突变基因会使细胞内的GLUT1超表达,GLUT1将DHA转运到细胞内,导致细胞死亡。
维生素C选择性杀死KRAS、BRAF基因突变结直肠癌细胞的机理
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)被称之为“能量感应器”。当细胞内AMP/ATP比值升高时,AMPK被激活[18]。激活的AMPK一方面可以磷酸化多种酶类来抑制脂肪酸、胆固醇以及蛋白质等合成,从而减少ATP的消耗;另一方面,AMPK积极的促进脂肪酸氧化、葡萄糖转运等来提高ATP的产量[19]。Yun J等[7]用LC-MA/MA 来观察,发现在未接受维生素C治疗的情况下,致癌基因可诱发AMPK 蛋白激酶,增高突变细胞内代谢水平,使其与普通细胞株相比糖酵解和磷酸戊糖途径(pentose phosphate pathway,PPP)代谢水平升高。磷酸戊糖途径为细胞提供其代谢所需的NADPH,NADPH作为GSH还原酶的辅酶,对维持细胞中还原性GSH含量以及保护含巯基的蛋白质或酶免受氧化剂的损害起到重要作用。
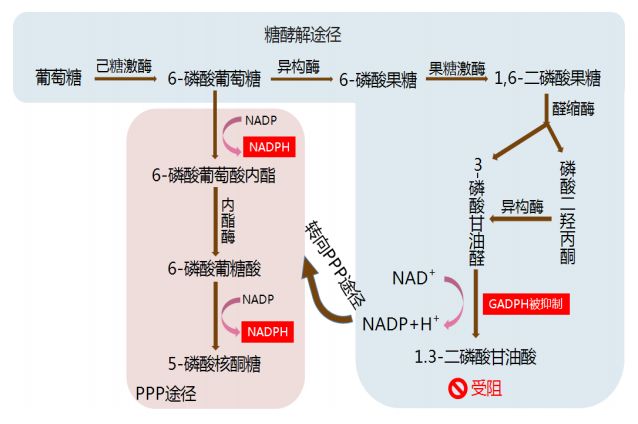
图1 接受维生素C治疗状态下,突变细胞内的糖代谢途径
注:维生素C的摄入抑制了GAPDH活性,致使糖酵解反应受阻,转而通过 PPP 代谢为细胞提供 ATP。DHA在细胞内被还原成维生素C的过程中消耗大量NADPH,PPP 代谢的升高可以产生更多 NADPH 来试图保持细胞内 NADPH的含量。
1 DHA抑制肿瘤细胞内GAPDH活性
实验发现细胞株在给予维生素C治疗后的代谢发生显著变化:糖酵解途径阻塞,转而使得糖分解PPP途径升高。因此给出推断:维生素C的摄入抑制了三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),使得糖酵解途径中从三磷酸甘油醛催化成1.3二磷酸甘油酸的步骤受阻。Yun J等[7]将接受维生素C治疗中的突变细胞株里加入还原剂NAC-N 后,维生素C治疗的效果被抵消。将突变细胞株加入可以进入三羧酸循环的丙酮酸和草酰已酸来保证ATP的产出,同样防止了细胞株因能源衰竭而导致的死亡。将接受维生素C治疗的突变细胞株里加入丙酮酸抑制剂鱼藤酮(rotenone),维生素C的毒性效果增强。三组实验证明“DHA的摄入抑制GAPDH从而抑制糖酵解反应,最终细胞耗尽ATP死亡”的假设成立。肿瘤细胞株因糖分解受到抑制而导致了线粒体底物缺乏造成ATP的耗尽导致凋亡。
实验表明,维生素C抑制GAPDH活性的机理,一部分由于蛋白质谷胱甘肽化,另一个原因是NAD+底物的下降。首先,GAPDH的活性中心半胱氨酸(systeine)中的巯基对氧化还原反应极为敏感,是活氧性家族(reactive oxygen species,ROS)的作用目标。因此ROS的过量表达可以导致GAPDH被糖基化后活性受到抑制。半胱氨酸可通过蛋白质谷胱甘肽化反应氧化成次磺酸,进而与GSH反应形成混合二硫键,导致GAPDH失活。其次,在糖酵解反应中,三磷酸甘油醛催化形成1.3-二磷酸甘油酸的过程不仅需要GADPH的参与,还需要辅酶NAD+参与接收氢离子转化为NADH。而过量的ROS可诱导DNA损伤,DNA修复酶PARP被激活后通过消耗NAD+来合成ADP-核糖聚合物,从而抑制NADPH活性[20]。在Yun J等人[7]的实验中,第一组细胞株中给予PARP抑制剂从而达到减少NAD+消耗的目的,结果显示维生素C效果减弱;第二组细胞株给予可渗透细胞的NAD+前体NMN从而达到减少PARP的目的,结果显示维生素C效果减弱。因此可以得出结论:翻译后修饰和NAD+耗尽都会抑制NADPH活性[7]。
2 DHA提高体内ROS含量
DHA在被还原成维生素C的过程中会消耗掉大量还原剂GSH和NADPH,抗氧化剂的大量消耗导致细胞内ROS的增多[21]。因此,为了维持NADPH在细胞内的浓度使得PPP代谢水平增加[22]。ROS是一类具有比分子,更活泼的化学反应性的含氧物,在体内维持在一个稳定的范围内。早期研究表明ROS的升高会导致恶性肿瘤的发生,近年来随着对ROS的深入研究发现,ROS也具有杀伤肿瘤细胞的作用。ROS在细胞内可以损伤DNA和生物膜系统,并使蛋白质造成氧化损伤。由于与正常细胞相比,肿瘤细胞内抗氧化酶活性较低,对ROS清除效率低,因此在一定浓度的情况下ROS只对肿瘤细胞有损伤,对正常细胞损伤较低。目前已有许多相关药物是通过增加细胞内ROS的产生来诱导肿瘤细胞凋亡达到抗肿瘤的效果。代晓阳等[23]以HepG2肝脏肿瘤细胞株为研究对象,通过给予不同剂量的双氧水(H2O2)来观察细胞凋亡发生情况及氧化损伤情况。结果表明,适当剂量的活性氧可以诱导肿瘤细胞凋亡,低剂量的活性氧可造成细胞的损伤,使细胞具有凋亡的趋势。活性氧在肿瘤细胞凋亡中具有细胞调控作用。
无论是蛋白质谷胱甘肽化还是NAD+的消耗,其根本原因是维生素C摄入后内源性活性氧ROS的升高所导致。综上所述,维生素C选择性通过GAPDH杀灭KRAS、BRAF基因突变肿瘤细胞机理是:DHA通过突变细胞高表达的GLUT1通道进入细胞,从而与GSH,NADPH还原物质发生反应还原成维生素C,还原物质的消耗导致ROS的升高,ROS升高后通过蛋白质谷胱甘肽化和诱导DNA损伤消耗NAD+,使得糖分解中的重要酶GAPDH活性受到抑制,最终ATP耗尽导致细胞死亡。
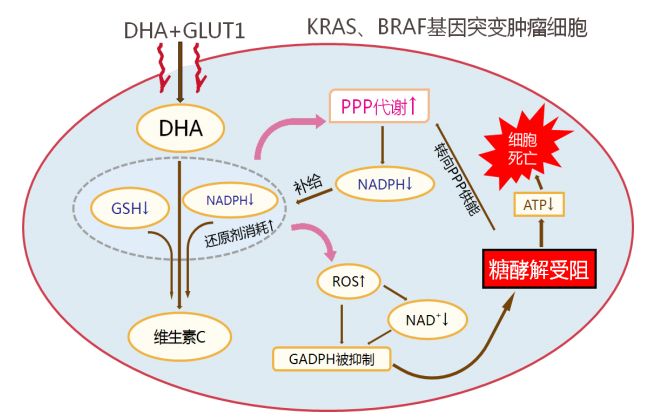
图2 维生素C选择性杀死KRAS、BRAF突变基因结直肠癌细胞的机理
注:DHA 被还原过程中消耗细胞内大量还原剂GSH、NADPH 并导致了ROS的升高,从而使GAPDH活性受到抑制而降低 ATP的生成,最终导致细胞死亡。
总结与展望
一系列的科学实验论证了高剂量维生素C静脉注射对于含KRAS、BRAF突变基因的结直肠癌的治疗效果,为治疗KRAS、BRAF突变基因导致的结直肠癌提供了重要理论支持。维生素C利用肿瘤细胞能量代谢特点和细胞内的氧化还原态,达到对KRAS、BRAF突变基因肿瘤细胞灭杀的效果,并且在治疗时所需的维生素C的剂量在人体安全范围内,因此在短期内维生素C的抗肿瘤治疗有望进入临床试验研究中。此外,利用细胞能量代谢的特点,未来可以将维生素C的治疗与生酮饮食结合进行试验研究:一方面截断碳水化合物的饮食来源;另一方面通过DHA的体内注射截断肿瘤细胞内的糖分解途径,来观察维生素C与生酮饮食是否具有协同作用。
参考文献
1. 荆晓娟, 杜冀晖,贺克俭.维生素C在肿瘤治疗中的作用研究进展.医学综述 .2010;16(4):554-557.
2. Cameron E, Pauling L. Supplemental ascorbate in the supportive treatment of cancer: reevaluation of prolongation of survival times in terminal human cancer. Proc Natl Acad Sci USA.1978;75(9):4538-4542.
3. Du J, Cullen J, Buettner G. Ascorbic acid: chemistry, biology and the treatment of cancer. Biochim Biophys Acta.2012;1826(2):443-457.
4. Graumlich JF, Ludden TM, Conry-cantilena C, et al. Pharmacokinetic model of ascorbic acid in healthy male volunteersduring depletion and repletion. Pharm Res.1997;14(9):1133-1139.
5. Padayatty SJ, Sun H, Wang Y, et al. Vitamin C pharmacokinetics: implicatiONSfor oral and intravenous use. Ann Intern Med.2004;140(7):533-537.
6. Levine M, Conry-Cantilena C, Wang Y, et al. Vitamin C pharmacokinetics in healthy volunteers: evidence for a recommended dietary allowance. Proc Natl Acad Sco USA.1996;93(8):3704-3709.
7. Yun J, Mullarky E, Lu C, et al. Vitamin C selectively killsKRASand BRAFmutant colorectal cancer cells by targetingGAPDH. Science.2015.[Epub ahead of print]
8. 刘启梁, 黄庆愿 .肿瘤细胞能量代谢特点及其意义.生命的化学.2015;35(3):387-391.
9. 石汉平,凌文华,李薇.肿瘤营养学.北京:人民卫生出版社,2012:891-899.
10. 鲁运新,石汉平.生酮饮食与肿瘤治疗.肿瘤代谢与营养电子杂志 .2015;2(1):61-66.
11. Klement RJ. Restricting carbohydrates to fight head and neck cancer-is this realistic? Cancer Biol Med.2014;11(3):145-161.
12. Lievre A, Bachet JB, Le CORRe D, et al.KRASmutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res.2006;66(8):3992-3995.
13. Di Nicolantonio F, Martini M, Molinari F, et al. Wild-type BRAFis required for response to panitumumab or cetuximab in metastatic colorectal cancer. J Clin Oncol. 2008;26(35):5705-5712.
14. Wichendend A, Jin H, Johnson M, et al. Colorectal cancer cells with the BRAF(V600E) mutation are addicted to the ERK1/2 pathway for growth factor-independent survival and repression of BIM. Oncogene.2008;27(57):7150-7161.
15. Karapetis CS, Khambata-Ford S, Jonker DJ, et al. K-ras mutatiONSand benefit from cetuximab in advanced colorectal cancer. N Engl J Med.2008;359(17):1757-1765.
16. Chen SW, Chiang HC, Chen WT, et al. CORRelation between PET/CT parameters andKRASexpression in colorectal cancer. Clin Nucl Med.2014;39(8):685-689.
17. Linster CL, Van Schaftingen E. Vitamin C. Biosynthesis, recycling and degradation in mammals. FEBS J.2007;274(1):1-22.
18. 郑杰.肿瘤生长的能量代谢特点及其临床应用.中国细胞生物学学报 .2011;33(10):1158-1165.
19. Hardie DG, Hawley SA, Scott JW. AMP-activated protein kinasedevelopment of the energy sensor concept. J Physiol.2006;574(1): 7-15.
20. Alano CC, Garnier P, Ying W, et al. NAD+depletion is necessary and sufficient for poly(ADP-ribose)polymerase-1-mediated neuronal death. J Neurosci.2010;30(8):2967-2978.
21. Ralser M, Wamelink MM, Kowald A, et al. Dynamic rerouting of the carbohydrate flux is key to counteracting oxidative stress. J Biol.2007;6(4):10.
22. Pastore A, Federici G, Bertini E, et al. Analysis of glutathione: implication in redox and detoxification. Clin Chim Acta.2003;333 (1):19-39.
23. 代晓阳, 卿晨.细胞活性氧(ROS)与肿瘤发生及干预的关系.中国民族民间医药.2011;20(6):7-8.