研究背景
研究方法
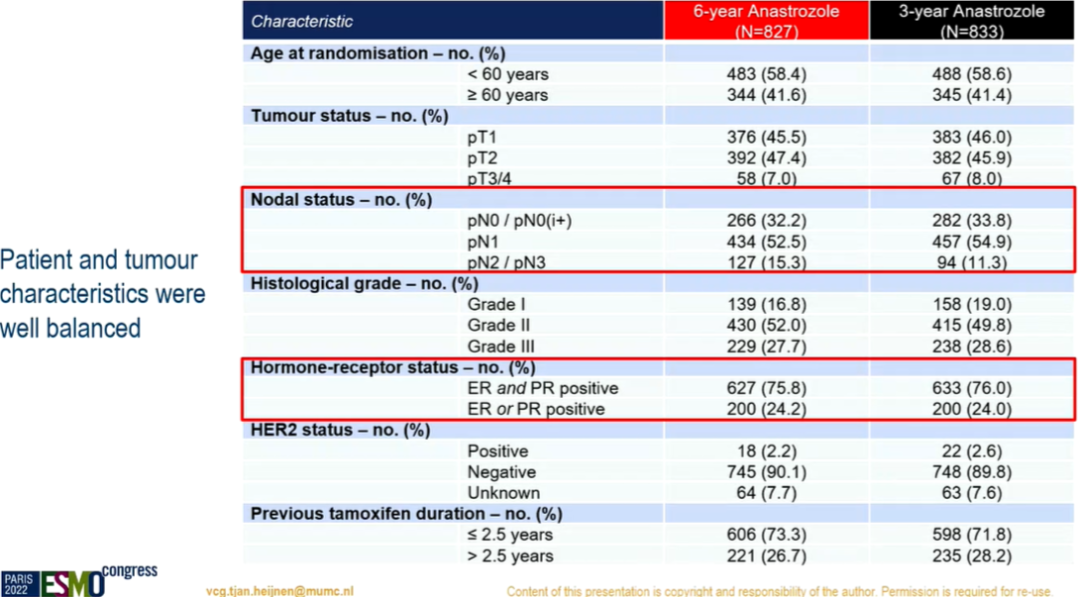
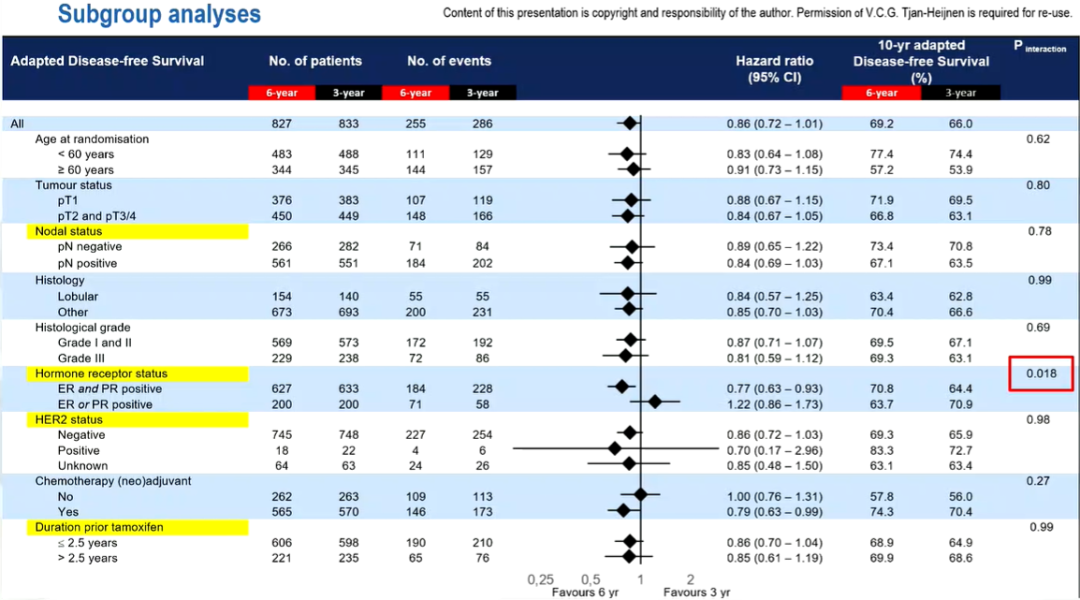
研究结果
-
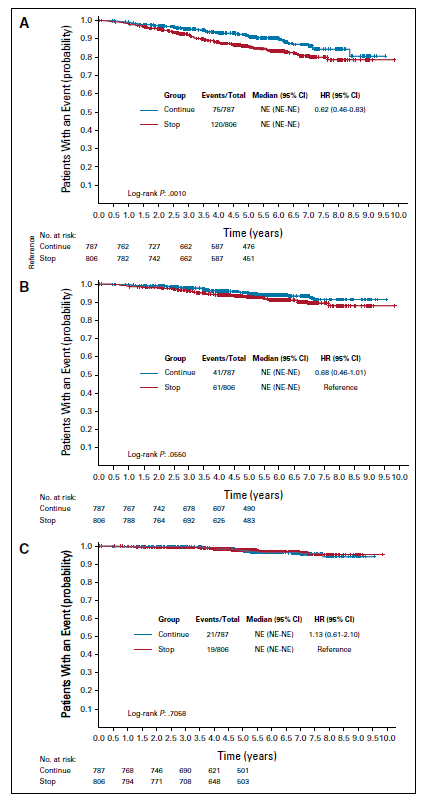
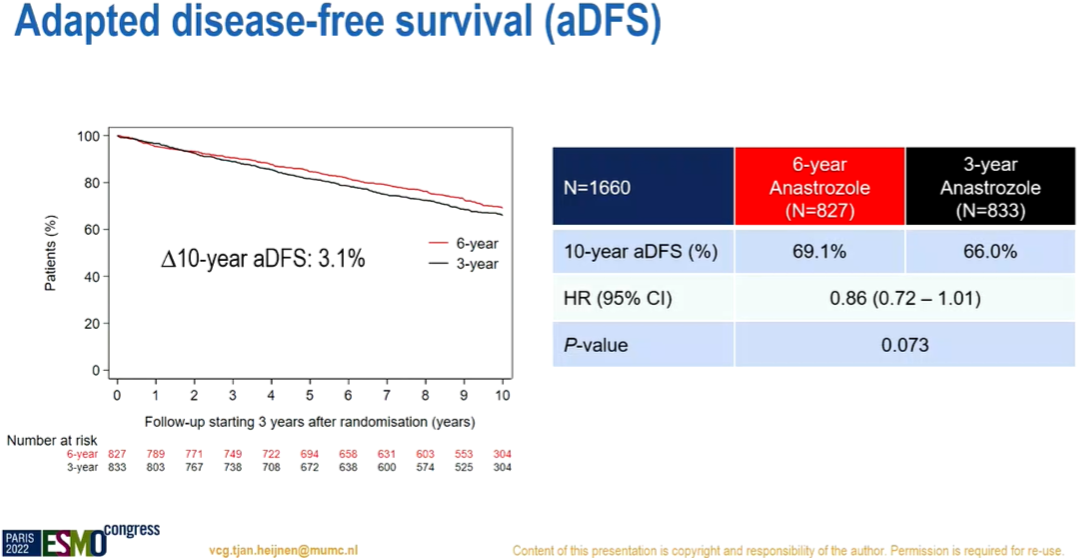
10年校正后无病生存率:69.1%比66%(风险比:0.86,95%置信区间:0.72~1.01,P=0.073) -
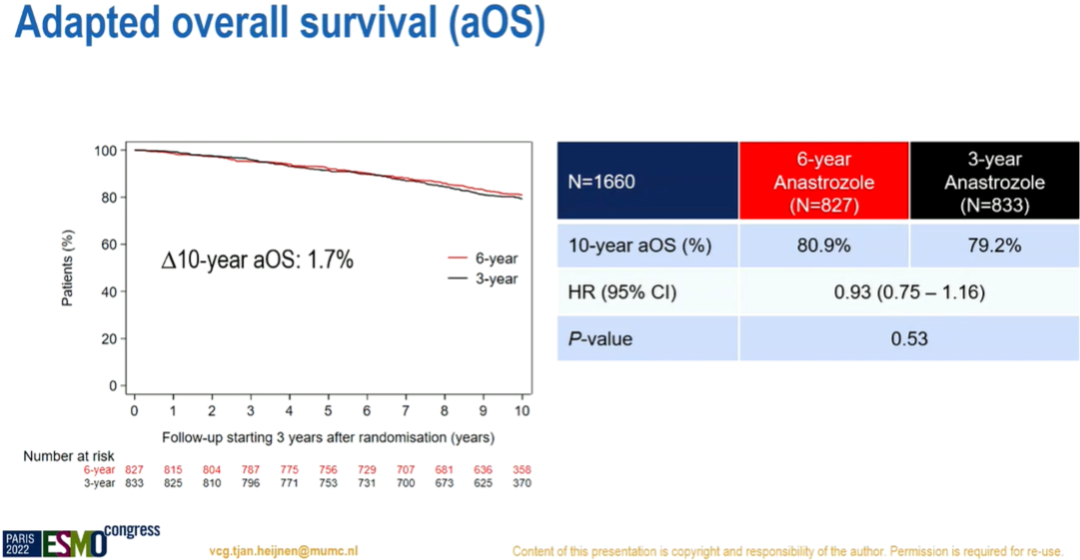
10年校正后总生存率:80.9%比79.2%(风险比:0.93,95%置信区间:0.75~1.16,P=0.53)
-
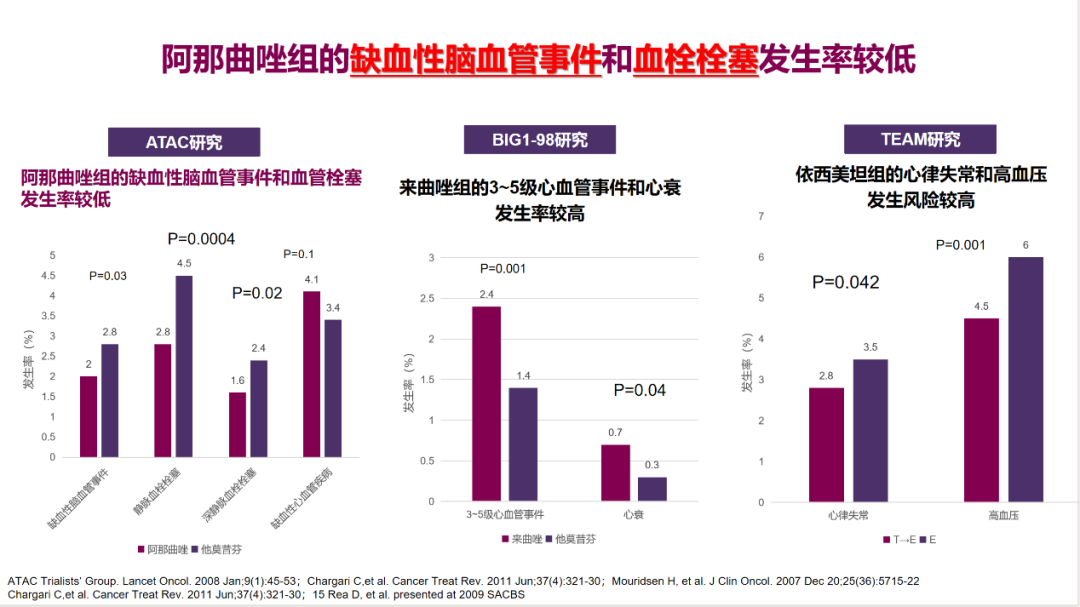
两种激素受体阳性:10年校正后无病生存率较高(风险比:0.77,95%置信区间:0.63~0.94,P=0.008) -
一种激素受体阳性:10年校正后无病生存率相似(风险比:1.22,95%置信区间:0.86~1.73,P=0.28)
研究结论
新见点评
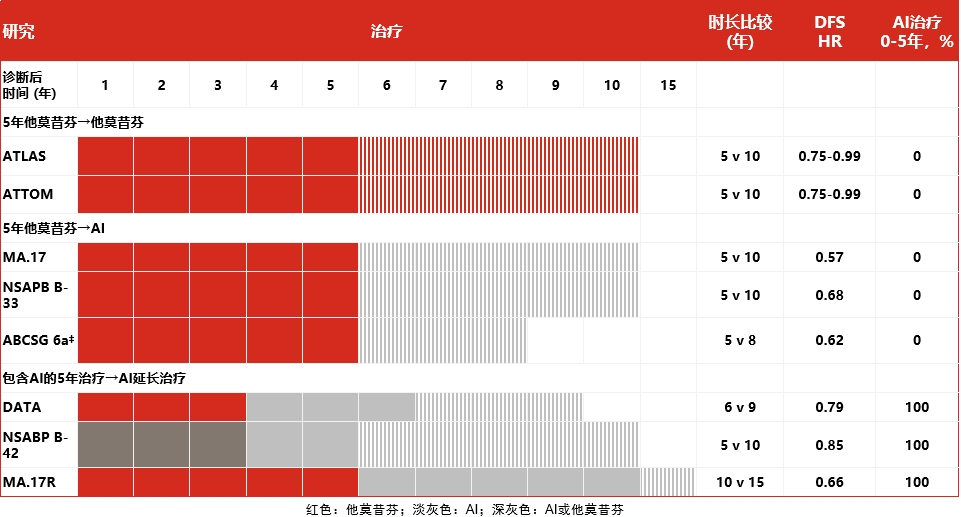
内分泌延长治疗策略最早是从ATLAS[9]、ATTOM[10]等研究中的他莫昔芬序贯他莫昔芬开始,到MA.17[11]、NSABP B-33[12]等研究的他莫昔芬序贯芳香化酶抑制剂,再到MA.17R[13]、NSABP B-42[14]、IDEAL[15]等研究的芳香化酶抑制剂序贯芳香化酶抑制剂。这些主要研究对内分泌延长治疗策略的探索给出了不同的方案,所呈现的结果也并不完全一致。
参考文献
-
Sgroi DC, Sestak I, Cuzick J, et al. Prediction of late distant recurrence in patients with oestrogen-receptor-positive breast cancer: a prospective comparison of the breast-cancer index (BCI) assay, 21-gene recurrence score, and IHC4 in the TransATAC study population. Lancet Oncol 2013;14: 1067-76. -
Ruhstaller T, Giobbie-Hurder A, Colleoni M, et al. Adjuvant Letrozole and Tamoxifen Alone or Sequentially for Postmenopausal Women With Hormone Receptor-Positive Breast Cancer: Long-Term Follow-Up of the BIG 1-98 Trial. J Clin Oncol. 2019;37(2):105-114. -
Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials. Lancet 2015;386: 1341-52. -
Goss PE, Ingle JN, Martino S, et al. A randomized trial of letrozole in postmenopausal women after five years of tamoxifen therapy for early-stage breast cancer. N Engl J Med. 2003;349(19):1793-802. -
中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2021年版). 中国癌症杂志. 2021;31(10):954-1040. -
中国临床肿瘤学会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2022). 北京:人民卫生出版社. 2022. -
Denduluri N, Mark RS, Mariana CM, et al. Selection of Optimal Adjuvant Chemotherapy and Targeted Therapy for Early Breast Cancer: ASCO Guideline Update. J Clin Oncol. 2021;39(6):685-693. -
Tjan-Heijnen VCG, Lammers SWM, Geurts SME, et al. Extended adjuvant aromatase inhibition after sequentialendocrine therapy: Final results of the phase III DATA trial. 2022 ESMO abstract 133O. -
Davies C, Pan H, Godwin J et al. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis ofoestrogen receptor-positive breast cancer: ATLAS, a randomised trial. Lancet 2013;381(9869): 805-816. -
Bartlett JMS, Sgroi DC, Treuner K, et al. Breast Cancer Index and prediction of benefit from extended endocrine therapy in breast cancer patients treated in the Adjuvant Tamoxifen-To Offer More? (aTTom) trial. Ann Oncol. 2019;30(11):1776-1783. -
Jin H, Tu D, Zhao N, et al. Longer-term outcomes of letrozole versus placebo after 5 years of tamoxifen in the NCIC CTG MA.17 trial: analyses adjusting for treatment crossover. J Clin Oncol. 2012;30(7):718-21. -
Mamounas EP, Jeong JH, Wickerham DL, et al. Benefit from exemestane as extended adjuvant therapy after 5 years of adjuvant tamoxifen: intention-to-treat analysis of the National Surgical Adjuvant Breast And Bowel Project B-33 trial. J Clin Oncol. 2008;26(12):1965-71. -
Goss PE, Ingle JN, Pritchard KI, et al. Extending Aromatase-Inhibitor Adjuvant Therapy to 10 Years. N Engl J Med. 2016;375(3):209-19. -
Mamounas EP, Bandos H, Lembersky BC, et al. Use of letrozole after aromatase inhibitor-based therapy in postmenopausal breast cancer (NRG Oncology/NSABP B-42): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2019;20(1):88-99. -
Blok EJ, Kroep JR, Meershoek-Klein Kranenbarg E, et al. Optimal Duration of Extended Adjuvant Endocrine Therapy for Early Breast Cancer; Results of the IDEAL Trial (BOOG 2006-05). J Natl Cancer Inst. 2018;110(1). -
Tjan-Heijnen VCG, van Hellemond IEG, Peer PGM, et al. Extended adjuvant aromatase inhibition after sequential endocrine therapy (DATA): a randomised, phase 3 trial. Lancet Oncol. 2017;18(11):1502-1511. -
EBCTCG SABCS 2018 Abstract GS3-03 Effects of prolonging adjuvant aromatase inhibitor therapy beyond five years on recurrence and cause-specific mortality: an EBCTCG meta-analysis of individual patient data from 12 randomised trials. -
Ohtani H et al. SABCS 2018 Abstract GS3-04 A prospective randomized multi-center open-label phase III trial of extending aromatase-inhibitor adjuvant therapy to 10 years -Results from 1697 postmenopausal women in the N-SAS BC 05 trial: Arimidex extended adjuvant randomized study (AERAS). -
Harbeck N, Rastogi P, Martin M, et al. Adjuvant Abemaciclib combined with endocrine therapy for high-risk early breast cancer: updated efficacy and Ki-67 analysis from the monarchE study. Ann Oncol. 2021;32(12):1571-1581. -
Tutt ANJ, Garber JE, Kaufman B, et al., Adjuvant Olaparib for Patients with BRCA1- or BRCA2-Mutated Breast Cancer. N Engl J Med. 2021;384(25):2394-2405.